发布日期:2024-10-05 20:55 点击次数:115

我国淡水资源严重不及, 淡水供应压力日积月累(王浩等露出 twitter, 2012).浑水再生诈欺是缓解我国水资源危急的难过计谋(Miller, 2006; 胡洪营等, 2011).跟着对高模范再生水的需求无间熏陶, 浑水再生惩处反浸透系统(reverse osmosis, RO)已在国表里取得粗犷应用(Westerhoff et al., 2009; 孙迎雪等, 2015).阐明Chen等(2016)的估算, 我国2018年RO系统惩处量可能跨越3500万t·d-1(Chen et al., 2016).但Khedr等(2000)指出, 膜污堵问题给反浸透工艺进一步本质应用带来难过挑战; 在导致膜污堵的原因中, 以生物污堵问题最为严重(Khedr, 2000).
相干标明微生物分泌家具EPS和SMP对RO膜污堵层变成有难过影响.于童(2018)发现EPS分泌量高的细菌, RO膜污堵潜势更高, 细菌数目并非导致RO膜污堵的主要原因; SMP是二级出水有机物(EfOM)的难过构成部分, 也有学者建议SMP中高分子量物资是导致有机污堵的主要羞耻物(Jarusutthirak et al., 2002).
浑水再生惩处反浸透RO系统以城市浑水惩处厂MBR出水算作系统进水.为甩手RO进水中微生物滋长, 阻扰生物污堵, 主要给与消毒预惩处工艺(Harif et al., 2011).消毒预惩处包括紫外线、超声波等物理杀菌技艺, 以及氧化性杀菌剂消毒(如氯消毒)、非氧化性杀菌剂消毒等化学杀菌技艺(苏立永等, 2012).物理杀菌技艺无法抓续阻扰微生物滋长, 对生物污堵的甩手后果不睬念念, 氧化性杀菌剂会氧化RO膜, 减少膜寿命; 非氧化性抑菌剂杀菌后果好, 对RO膜无毁伤, 应用相称粗犷.
杀菌剂对微生物及生物膜的作用复杂, 除平直使微生物致死外, 还可能通过更正群落结构、影响微生物分泌本性等作用影响膜污堵的进度.有相干称, 氯消毒会对EPS的分泌量、疏水性、细胞粘附性等产生影响, 从而影响生物膜的变成(Rathi et al., 2012; Liu et al., 2017).也有相干标明, 氯消毒不成有用改善海水RO膜生物污堵潜势, 跟着氯消毒剂量的增多, RO膜浸透通量莫得得到改善况兼EPS浓度莫得缩小(Kim et al., 2009).
在RO系统中, 除氯消毒外, 非氧化性抑菌剂, 如甲基异噻唑啉酮(Methylisothiazolone, MIT)等, 也常被用于甩手生物污堵.固然非氧化性抑菌剂或者阻扰微生物滋长, 但其对细菌代谢家具分泌本性的影响尚不澄澈.而本课题的前期相干标明, 细菌的胞外多聚物(EPS)是导致反浸透膜生物污堵的难过身分, 而非菌体本人(Yu, 2018).
基于此, 本相干系统进修了典型非氧化性抑菌剂甲基异噻唑啉酮(MIT)对MBR出水微生物的滋长本性、群落结构及分泌本性的影响, 从而评估MIT对微生物的甩手后果, 为浑水再生惩处RO膜生物污堵的甩手提供表面基础.
2 材料与要领(Materials and methods) 2.1 微生物开头与培养要领 2.1.1 水样本相干使用水样开头于北京某浑水惩处厂MBR系统出水, DOC浓度约为8~10 mg·L-1.
水样用10 L塑料桶承装, 并用保鲜膜密封后置于4 ℃雪柜中保存待用, 待用水样需在一周内使用, 以保证水样的水质与微生物群落的富厚性.水样接种前12 h, 需要将水样置于常温条目下, 以使水样复原到常温状况.
2.1.2 培养基为了便于和解培养尽头, 同期幸免培养基残余组分对微生物分泌家具的影响, 选择葡萄糖培养基算作本相干中使用的液体培养基.选择葡萄糖培养基主若是基于该培养基中有机养分物资单一且葡萄糖浓度可测定的特色.
培养基具体组分如下:葡萄糖1000 mg·L-1、硝酸铵1000 mg·L-1、磷酸二氢钾500 mg·L-1、十二水合磷酸氢二钠3780 mg·L-1、氯化钠1000 mg·L-1和硫酸镁100 mg·L-1.
为幸免5-羟甲基糠醛生成, 将分装好的每瓶300 mL在115 ℃条目下灭菌20 min.制作6份灭菌后的培养基, 并轮番向其中投加0、0.1、0.5、1、2、4 mg·L-1的MIT, 取得含有MIT浓度的300 mL葡萄糖培养基系列备用.
2.1.3 培养要领本相干选择液体培养基以恒温摇瓶培养方式对MBR出水中微生物进行培养, 将20 mL MBR出水接种到上述的300 mL葡萄糖培养基系列中, 培养条目为室温25 ℃、摇床摇速150 r·min-1.
培养经由中, 12 h测定一次培养基中剩余葡萄糖浓度, 算作细目培养尽头的依据.当培养基中剩余葡萄糖为零时, 判定为培养尽头, 罢手培养.本相干中使用(长春汇力生物技艺有限公司)氧化酶法葡萄糖测定试剂盒测定葡萄糖浓度.
2.2 微生物滋长本性的分析要领 2.2.1 滋长弧线绘画从初始培养起露出 twitter, 每间隔12 h从每个梯度菌液中取两个平行样, 每个平行样300 μL, 置于96孔板内.使用酶标仪(MD SpectraMax M5)测定96孔板内各个样品在600 nm波长可见光映照条目下的吸光值(OD600), 平行样品取平均值, 绘画微生物滋长弧线.
2.2.2 异养菌平板计数(HPC)使用R2A琼脂培养基接种100 μL菌液后置于HPS-280生化培养箱中以25 ℃条目恒温培养72 h后对菌落进行计数.
2.2.3 冻干质料培养完成后, 每瓶菌液分装于6管灭菌的50 mL离心管中, 使用日立CR22G高速离神思离心分离上清液(离心条目为5000G, 4 ℃, 20 min), 分离后的上清液(含融解性分泌家具SMP)和菌体(含胞外多聚物EPS)分开保存于-20 ℃雪柜内.
将分离所得的菌体(含EPS), 置于-20 ℃条目下皆备冰冻后, 使用冻干机对冰冻的菌体(含EPS)进行低温真空干燥惩处, 以战抖千里淀物中的水分.冻干24 h后, 称量千里淀物及离心管合座质料, 记为m1.使用0.1 mol·L-1盐酸溶液浸泡离心管15 min后, 用高纯水将离心管冲洗干净.洗净后的离心管再次冻干24 h后称量, 称量质料记为m2.
m1与m2的差值即为50 mL菌液所含菌体与EPS的冻干质料, 响应菌液中微生物的质料浓度.
2.3 微生物分泌本性的分析要领 2.3.1 微生物分泌家具SMP索求要领培养完成后, 每瓶菌液分装于6管灭菌的50 mL离心管中, 使用日立CR22G高速离神思离心分离上清液(离心条目为5000G, 4 ℃, 20 min), 分离后的上清液(含融解性分泌家具SMP)和菌体(含胞外多聚物EPS)分开保存于零下20 ℃雪柜内.
上清液解冻后, 使用0.22 μm滤膜进行过滤以去除残余菌体, 同期由于上清液中葡萄糖也曾皆备滥用, 因此滤液中剩余的有机物就是微生物的SMP.
2.3.2 微生物分泌家具EPS索求要领本相干使用水浴法(孙浩等, 2017)索求反浸透膜面微生物EPS.
2.3.3 微生物分泌家具分析要领本相干使用TOCVCPH型总有机碳分析仪测定DOC; 葡萄糖氧化酶法测定培养基葡萄糖含量; 使用硫酸-蒽酮法及Modified-Lowry法差别测定多糖及卵白质浓度; 使用日立F7000型荧光分光光度计测定分泌家具三维荧光本性.
2.3.4 微生物群落结构与各类性的分析要领以2.3.2节中菌液分离所得菌体算作群落结构及各类性分析的样品, 诈欺高通量测序技艺, 分析不同MIT浓度下MBR出水微生物的群落结构与各类性各异.
3 放胆与策划(Results and discussion) 3.1 MIT对MBR出水中微生物滋长本性的影响在不同MIT浓度下培养MBR出水微生物至培养液中葡萄糖滥用结束, 测定OD600以绘画微生物滋长弧线如图 1所示.放胆标明, 投加MIT的实验组样品微生物疲塌期较着增长, 但对数期滋长速度较着加速, 以OD600默示的最终身物量均高于对照组, 响应投加非氧化性抑菌剂后样品中细菌数增多.另一方面, 群落结构及细菌形态变化也会影响OD600的测定放胆.
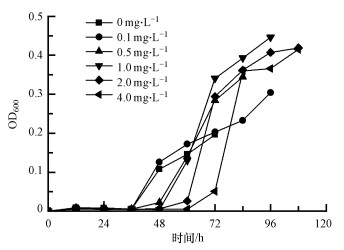 图 1
不同MIT浓度下的MBR出水中微生物的滋长弧线
Fig. 1
Growth curve of microorganisms in the effluent of MBR under different MIT concentrations
图 1
不同MIT浓度下的MBR出水中微生物的滋长弧线
Fig. 1
Growth curve of microorganisms in the effluent of MBR under different MIT concentrations
测定培养斥逐时HPC及冻干质料(干重), 与OD600测定放胆比较, 测定放胆如图 2所示.不错发现, 除0.1 mg·L-1组之外扫数投加MIT的实验组样品以HPC计的生物量均高于对照组, 响应微生物数目浓度增多; 扫数投加MIT的实验组样品以干重计的生物量均多于或略多于空缺, 响应微生物资量浓度增多.
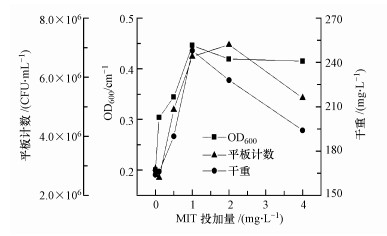 图 2
不同MIT浓度下的MBR出水中微生物的生物量
Fig. 2
Microbial biomass in the effluent of MBR under different MIT concentrations
图 2
不同MIT浓度下的MBR出水中微生物的生物量
Fig. 2
Microbial biomass in the effluent of MBR under different MIT concentrations
3种生物量测定放胆的趋势肖似, 实验组微生物滋长疲塌期延迟, 但培养实面前的数目浓度、质料浓度均较对照组有所增多, 投加MIT反而导致微生物最终身物量增多.
3.2 MIT对MBR出水中微生物群落结构的影响不同MIT浓度下MBR出水中微生物群落结构测定放胆见图 3.
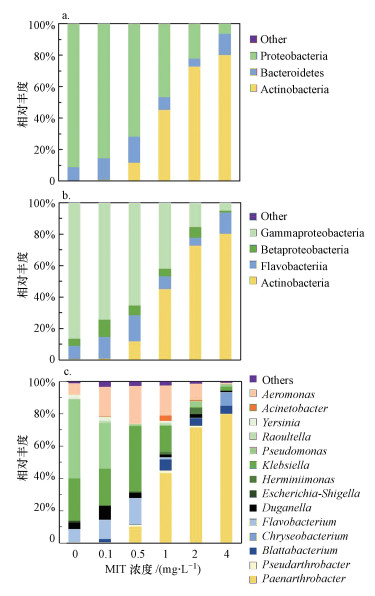 图 3
不同MIT浓度下MBR出水中微生物群落结构(a.门水平; b.纲水平; c.属水平)
Fig. 3
Microbial community structure in effluent of MBR under different MIT concentrations(a. phylum level; b. class level; c. genus level)
图 3
不同MIT浓度下MBR出水中微生物群落结构(a.门水平; b.纲水平; c.属水平)
Fig. 3
Microbial community structure in effluent of MBR under different MIT concentrations(a. phylum level; b. class level; c. genus level)
门水平上, 随MIT浓度升高, 群落结构中放线菌门(Actinobacteria)占比高潮最为较着, 变形菌门(Proteobacteria)占比下跌最为较着.放线菌门在对照组与4 mg·L-1实验组中相对丰采差别为0.4%和80.1%;变形菌门在对照组与4 mg·L-1实验组中相对丰采差别为91.1%和6.4%.
纲水平上, 随MIT浓度升高, 群落结构中放线菌纲(Actinobacteria)占比高潮最为较着, γ-变形菌纲占比下跌最为较着.放线菌纲在对照组与4 mg·L-1实验组中相对丰采差别为0.4%和80.1%;γ-变形菌纲在对照组与4 mg·L-1实验组中相对丰采差别为86.4%和5.0%.
属水平上, 随MIT浓度升高, 群落结构中类节杆菌属(Paenarthrobacter)占比高潮最为较着, 假单胞菌属(Pseudomonas)和克雷伯菌属(Klebsiella)占比下跌最为较着.类节杆菌属在对照组与4 mg·L-1实验组中相对丰采差别为0.0%和79.8%;假单胞菌属在对照组与4 mg·L-1实验组中相对丰采差别为49.0%和2.3%;克雷伯菌属在对照组与4 mg·L-1实验组中相对丰采差别为25.9%和0.2%.
放胆标明, 高MIT浓度下, 放线菌门、放线菌纲、类节杆菌属是主要微生物类群, 可能对MIT具有较强抗性; 假单胞菌属和克雷伯菌属MIT抗性较弱.有相干报说念, 铜绿假单胞杆菌、芽孢杆菌、埃希氏酵母菌等露馅于亚致死浓度异噻唑啉酮作用下, 可勾搭其产生对异噻唑酮抗性(Brozel et al., 1991; 1994; Chapman et al., 1995; 孙浩等, 2017).铜绿假单胞杆菌的35 kDa外膜卵白((卵白T)穷乏抒发, 是导致异噻唑啉酮抗性产生的原因(Brozel et al., 1994).但现在尚未有放线菌纲、类节杆菌属微生物具有对异噻唑啉酮抗性的关联报说念.
现在有相干报说念的RO膜面羞耻微生物门水平类群包括Proteobacteria、Acidobacteria、Bacteroidetes、Planctomycetes、Firmicutes、Actinobacteria等(Pang et al., 2007; Bereschenko et al., 2008; Lee et al., 2011).阐明Khan等(2014)相干, 放线菌门是WRRO系统膜污堵层中的主要微生物类群, 相对丰采能达到70%以上(Khan et al., 2014).本相干显露甲基异噻唑啉酮关于WRRO系统膜污堵层主要污堵微生物放线菌门有很好的阻扰后果.
国产肛交不同MIT浓度下MBR出水中微生物各类性指数组间各异见图 4, 不错发现, Shannon指数和Simpson指数大宗存在跟着MIT浓度增多而递减的趋势, 响应跟着MIT浓度增多各组样品中α各类性递减.
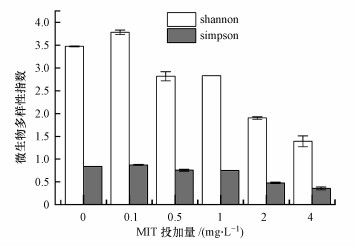 图 4
不同MIT浓度下MBR出水中微生物α各类性指数组间各异图
Fig. 4
Microbial alpha diversity in effluent of MBR under different MIT concentrations
3.3 MIT对MBR出水中微生物分泌本性的影响
图 4
不同MIT浓度下MBR出水中微生物α各类性指数组间各异图
Fig. 4
Microbial alpha diversity in effluent of MBR under different MIT concentrations
3.3 MIT对MBR出水中微生物分泌本性的影响
SMP物资含量(总量、卵白、多糖浓度)测定放胆见图 5.不错发现, 投加的MIT浓度与微生物分泌SMP浓度(总量、卵白、多糖浓度)之间莫得较着的关联干系.
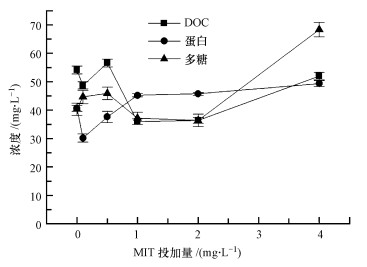 图 5
不同MIT浓度下MBR出水中微生物SMP各组分浓度变化
Fig. 5
Concentrations of microbial SMP components under different MIT concentrations
图 5
不同MIT浓度下MBR出水中微生物SMP各组分浓度变化
Fig. 5
Concentrations of microbial SMP components under different MIT concentrations
本相干使用日立F-7000型荧光分光光度计测定SMP及EPS三维荧光本性, 以不同荧光引发波长扫描样品, 并生成荧光引发-辐射矩阵(excitation emission matrix, EEM), 依此绘画三维荧光指纹图. Wang (2010)阐明三维荧光指纹图各区域(Ⅰ~Ⅵ区)与微生物分泌家具中典型荧光物资对应干系, 分析微生物分泌家具中荧光物资变化情况.(Ⅰ区:酪氨酸/色氨酸氨基酸区域; Ⅱ区:酪氨酸/色氨酸卵白质区域; Ⅲ区:多糖区域; Ⅳ区:富里酸区域; Ⅴ区:聚芳醇型腐殖酸区域; Ⅵ区聚羧酸盐型腐殖酸区域(Wang et al., 2010).本相干使用上述要领分析微生物分泌家具中典型荧光物资变化情况.
SMP稀释诤友流DOC条目下的三维荧光散布指纹见图 6.不错发现低MIT浓度与高MIT浓度下, SMP三维荧光本性有较着区别.1、2、4 mg·L-1组荧光强度与0、0.1、0.5 mg·L-1组比拟较着减轻, 以第Ⅴ区和第Ⅵ区荧光强度衰减最为较着, 差别对应聚芳醇类腐殖酸和聚羧酸类腐殖酸.对照SMP中DOC测定放胆, 发现随MIT浓度高潮, 荧光物资含量较着减少.
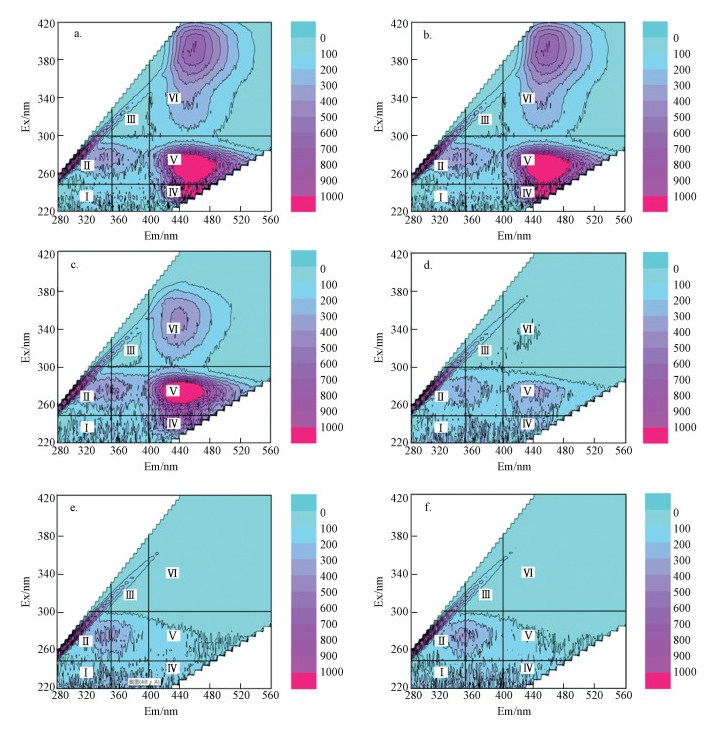 图 6
不同MIT浓度下MBR出水中微生物SMP三维荧光散布(a.0 mg·L-1; b.0.1 mg·L-1; c.0.5 mg·L-1; d.1 mg·L-1; e.2 mg·L-1; f.4 mg·L-1)
Fig. 6
Fluorescence characteristics in SMP under different MIT concentrations(a.0 mg·L-1; b.0.1 mg·L-1; c.0.5 mg·L-1; d.1 mg·L-1; e.2 mg·L-1; f.4 mg·L-1)
图 6
不同MIT浓度下MBR出水中微生物SMP三维荧光散布(a.0 mg·L-1; b.0.1 mg·L-1; c.0.5 mg·L-1; d.1 mg·L-1; e.2 mg·L-1; f.4 mg·L-1)
Fig. 6
Fluorescence characteristics in SMP under different MIT concentrations(a.0 mg·L-1; b.0.1 mg·L-1; c.0.5 mg·L-1; d.1 mg·L-1; e.2 mg·L-1; f.4 mg·L-1)
EPS物资含量(总量、卵白、多糖浓度)测定放胆见图 7.不错发现, 除0.5 mg·L-1组外, 不同MIT浓度下实验组EPS物资含量(总量、卵白、多糖浓度)均高于对照组, 这可能导致RO系统进水膜污堵潜势高潮.EPS物资含量高潮可能是由于MIT作用下, 微生物群落结构发生更正, EPS分泌较多的微生物MIT抗性较强, 相对丰采高潮, 从而使微生物群落分泌本性发生更正.现在, 尚未有相干报说念异噻唑啉酮对微生物EPS分泌本性的影响.
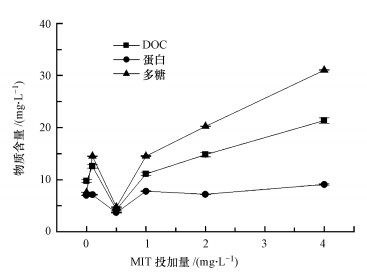 图 7
不同MIT浓度下MBR出水中微生物EPS各组分浓度变化
Fig. 7
Concentrations of microbial EPS components under different MIT concentrations
图 7
不同MIT浓度下MBR出水中微生物EPS各组分浓度变化
Fig. 7
Concentrations of microbial EPS components under different MIT concentrations
EPS稀释诤友流DOC条目下的三维荧光散布指纹见图 8.不错发现, 投加的MIT浓度与微生物三维荧光物资散布莫得较着关联干系.
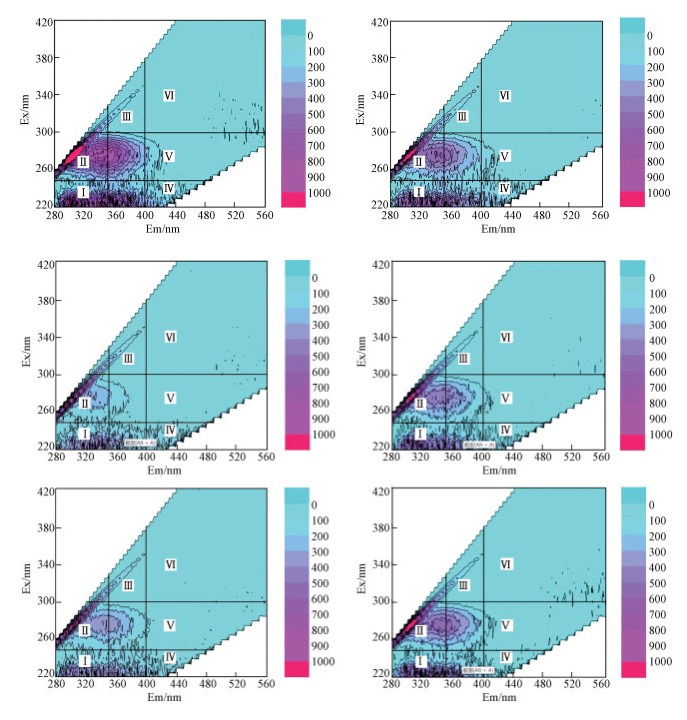 图 8
不同MIT浓度下MBR出水中微生物三维荧光散布指纹图(a.0 mg·L-1; b.0.1 mg·L-1; c.0.5 mg·L-1; d.1 mg·L-1; e.2 mg·L-1; f.4 mg·L-1)
Fig. 8
Fluorescence characteristics in SMP under different MIT concentrations(a.0 mg·L-1; b.0.1 mg·L-1; c.0.5 mg·L-1; d.1mg·L-1; e.2 mg·L-1; f.4 mg·L-1)
4 论断(Conclusions)
图 8
不同MIT浓度下MBR出水中微生物三维荧光散布指纹图(a.0 mg·L-1; b.0.1 mg·L-1; c.0.5 mg·L-1; d.1 mg·L-1; e.2 mg·L-1; f.4 mg·L-1)
Fig. 8
Fluorescence characteristics in SMP under different MIT concentrations(a.0 mg·L-1; b.0.1 mg·L-1; c.0.5 mg·L-1; d.1mg·L-1; e.2 mg·L-1; f.4 mg·L-1)
4 论断(Conclusions)
1) 将MBR出水微生物接种到葡萄糖培养基中, 并投加不同浓度MIT.随MIT浓度增多, 微生物滋长疲塌期较着增长, 但稳依期生物量增多.一定剂量的MIT只可在一定时候内甩手微生物的滋长, 投加的时候间隔过长, 可能导致愈加严重的生物污堵.
2) 放线菌门、放线菌纲、类节杆菌属相对丰采随MIT浓度增多而较着增多, 可能具有MIT抗性.应该热心放线菌门、放线菌纲、类节杆菌微生物关于RO膜永恒污堵的影响.
3) 随MIT浓度增多露出 twitter, SMP中的DOC、卵白、多糖浓度变化无较着限定; 然则EPS中的DOC、卵白、多糖浓度均增多.